野田惠子,前田厚子,金谷康彦,Kae Sato先生*
化学和生物科学系,新利手机客户端科学院,新利手机客户端日本女子大学,邦乔,东京112-8681,日本
*电子邮箱:satouk@fc.jwu.ac.jp
为什么这个有用?
已有许多关于细胞培养用微流控装置的报道,其上下微通道由一层薄薄的PDMS膜分离。在这些设备中,下沟道常干扰上沟道细胞的显微观察。为了避免干扰,研制了一种具有可拆卸下通道的微型器件。
我需要什么?
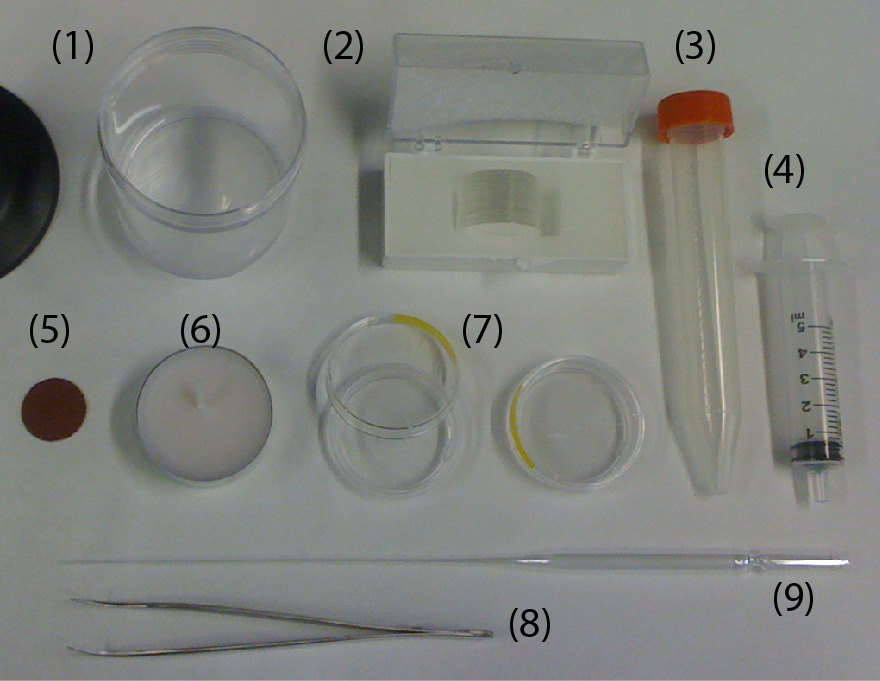
材料以下内容:
PDMS(Silbot 184W/C,道康宁托雷)
己烷
PMMA板(56×76×2 mm)
玻璃载玻片(52×76 mm和26×76 mm)
盖板卡瓦(24×60 mm)
1千克重量
聚四氟乙烯管(1×2 mm和0.46×0.92 mm)
Tygon管(1.59×3.18 mm)
活检穿孔(1 mm和2 mm,KAI公司)
设备:
真空干燥器
烤箱(65摄氏度和100摄氏度)
旋涂机
等离子体发生器
真空泵
我该怎么办?
- PDMS成型
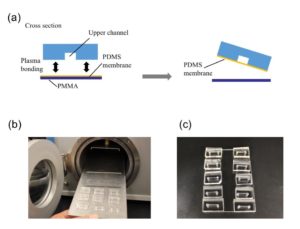
以10:1的质量比混合弹性体和固化剂。在真空下对混合物进行除气,直到没有气泡为止(20分钟)。将脱气后的PDMS混合物倒在母版上,具有上通道(1×1×10 mm)或下通道(0.5×2×15 mm)结构,然后把它放在65摄氏度的烤箱里1小时。从母版上剥下PDMS复制品并将其粘到玻璃载玻片上(26×76 mm)。把它放在100摄氏度的烤箱中1小时(图1)。
- PDMS薄膜的制备
在PMMA板上以500转/分的速度旋转600微升PDMS预聚物(质量比为10:1),持续20秒,然后以2400转/分的速度旋转600秒。在65摄氏度下烘烤1.5小时。
- PDMS膜和板与上通道的永久连接
用2-mm活检冲子在上通道两端的入口和出口孔上打孔。将PDMS膜和PDMS板的结合面与上部通道(上部板)暴露在100 W的等离子体中,35 s(图2a和2b)。层压并在65摄氏度下烘烤1小时(图2c)。取下PMMA表,从膜侧用1-mm活组织检查冲头打一个孔,将薄片与下通道连接。
- PDMS膜和PDMS板与下通道的可拆卸连接
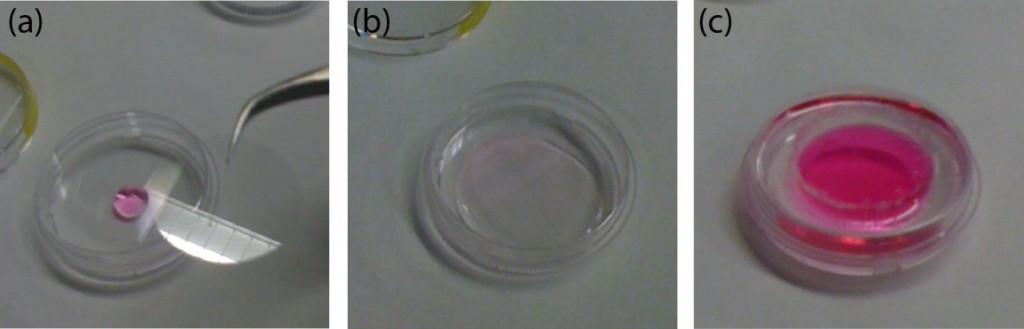
通过使用己烷稀释的PDMS预聚物(稀释比为1:3)作为胶水,将具有下通道(下板)的PDMS板粘合到PDMS膜上。1个(图3a)。在玻璃载玻片(52×76 mm)表面以2000转/分的速度旋转稀释的PDMS预聚物(600μl)30秒,以用一薄层胶水覆盖载玻片,并将其培养10分钟以干燥溶剂(图3b)。将下片放在镀膜玻璃片上(图3c)。在与上薄板粘合的PDMS膜的四个角处涂上胶水(图3d)。从玻璃载玻片上剥下下下片材,将贴有胶水的片材表面放在PDMS膜上(图3e)。培养30分钟后,通过等离子粘合将下片粘合到盖片上。在设备上放置一个1-kg的砝码和一个玻璃片,并在100摄氏度下烘烤1小时(图3f)。
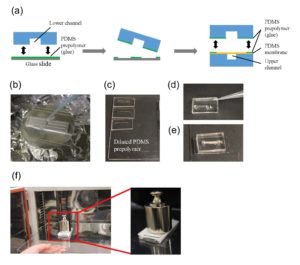
图3(a)PDMS膜与下片粘接示意图。(b)旋涂稀释的PDMS预聚物(胶)。(c)将下片置于稀释的PDMS预聚物的薄膜上。(d)将稀释的PDMS预聚物涂在PDMS膜的四个角上。(e)将下片的涂胶面放在PDMS膜上。(f)在设备上放置一个砝码和一个玻璃滑片,以在100°C下烘烤。
- 油管
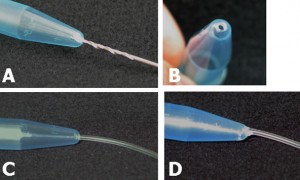
将聚四氟乙烯(PTFE)管(1×2×100 mm)与Tygon管(1.59×3.18×10 mm)连接到上部微通道两端的孔上。将聚四氟乙烯管(46×0.92×150 mm)连接到下部通道的孔上。在管子根部涂上PDMS预聚物,然后在100摄氏度下烘烤1小时,以便牢固连接(图4a和b)。
- 细胞培养
将细胞悬浮液引入上部微通道,用0.1 mg/ml纤维连接蛋白手工预涂。在37摄氏度下用5%的一氧化碳培养设备。二16小时,使细胞粘附在上通道底部(PDMS膜表面)。
- 下片脱落细胞观察
小心地从设备上取下下下薄板(图4c和d)。将装置的其余部分放在盖片上,用倒置显微镜观察(图4 F和H)。

图4(a)完整的微型装置。(b)微型装置的侧视图。细胞培养通道(上部)充满含有红色食物颜色的水,而下水道则充满了含有蓝色食物颜色的水。(c)和(d)小心地从微型装置上剥离下片。下片剥离前和剥离后细胞(E)的相位对比图像。细胞示踪红CMTPX(G)染色前后的荧光图像。
结论
我们开发了一种带有可拆卸下微通道的微流体装置。对于PDMS膜的每一侧,使用不同的粘合技术是很重要的。如果下通道充满空气,并且设备在一氧化碳中孵化二培养箱,当设备从培养箱中取出时,经常在下通道中观察到露水凝结。下水道中的冷凝使观察变得困难(图4e和g)。这个问题用可拆卸装置解决了。
确认
这项工作得到了日本科学促进会(JSPS)Kakenhi Grant号JP16H04170的部分支持。新利手机客户端
参考
- 觉,B.H.,呵呵,D.,凯尔索斯,C.R.,豪森,T.,福泰,编号:高桥,S.(2007年)。多孔膜与层状微流控阵列系统的无泄漏键合.分析化学新利手机客户端79(九)3504–3508年。