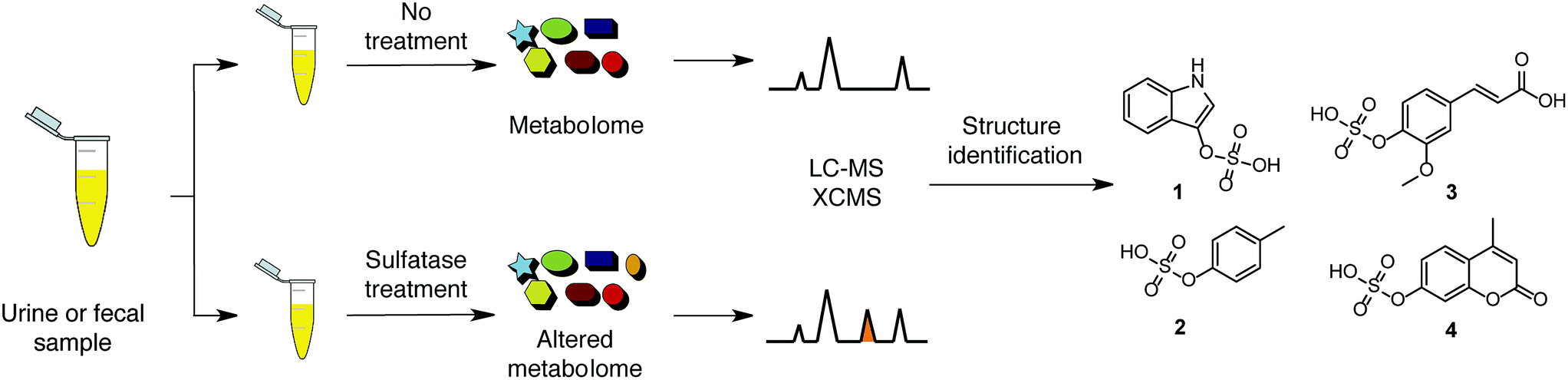
我知道你在想什么:“秋天来了!谁需要阳光和乐观?为我报名参加灰色天空和维生素D补充剂!.哦,你没想到?我也一样。也许万圣节会给你更多的快乐,除了有机会看到你的一个同事穿得像弗雷迪·墨丘利(Freddy Mercury),胸部印有“Hg”字样,经典)在部门聚会上?
本着万圣节的精神,诺丁汉大学的Simone Morra和Anca Pordea合成了一种突变的醇脱氢酶转化为Frankenstein催化剂。用共价结合的铑(III)络合物取代锌催化位点。所得到的突变/过渡金属复合物与野生型酶结合用于合成手性醇。(S)-4-苯基-2-丁醇。
像许多混合动力系统一样,将酶催化与过渡金属催化相结合的目的是利用各自的优点。数百万年的进化已经产生了在温和条件下起作用的酶催化剂,在水溶剂中,具有良好的选择性和催化效率。但是酶在一定范围内的作用在合成环境中是不利的。另一方面,过渡金属催化剂用途广泛,易于定制,与自由反应,使最混乱的酶脸红。
不幸的是,开发利用过渡金属和酶催化的多组分系统并不像将它们组合成单一混合物那么简单,因为通常会导致相互失活。作者发现将过渡金属复合物包裹在酶中提供了对抗抑制的物理屏障。保留了野生型酶和铑(III)配合物的活性。
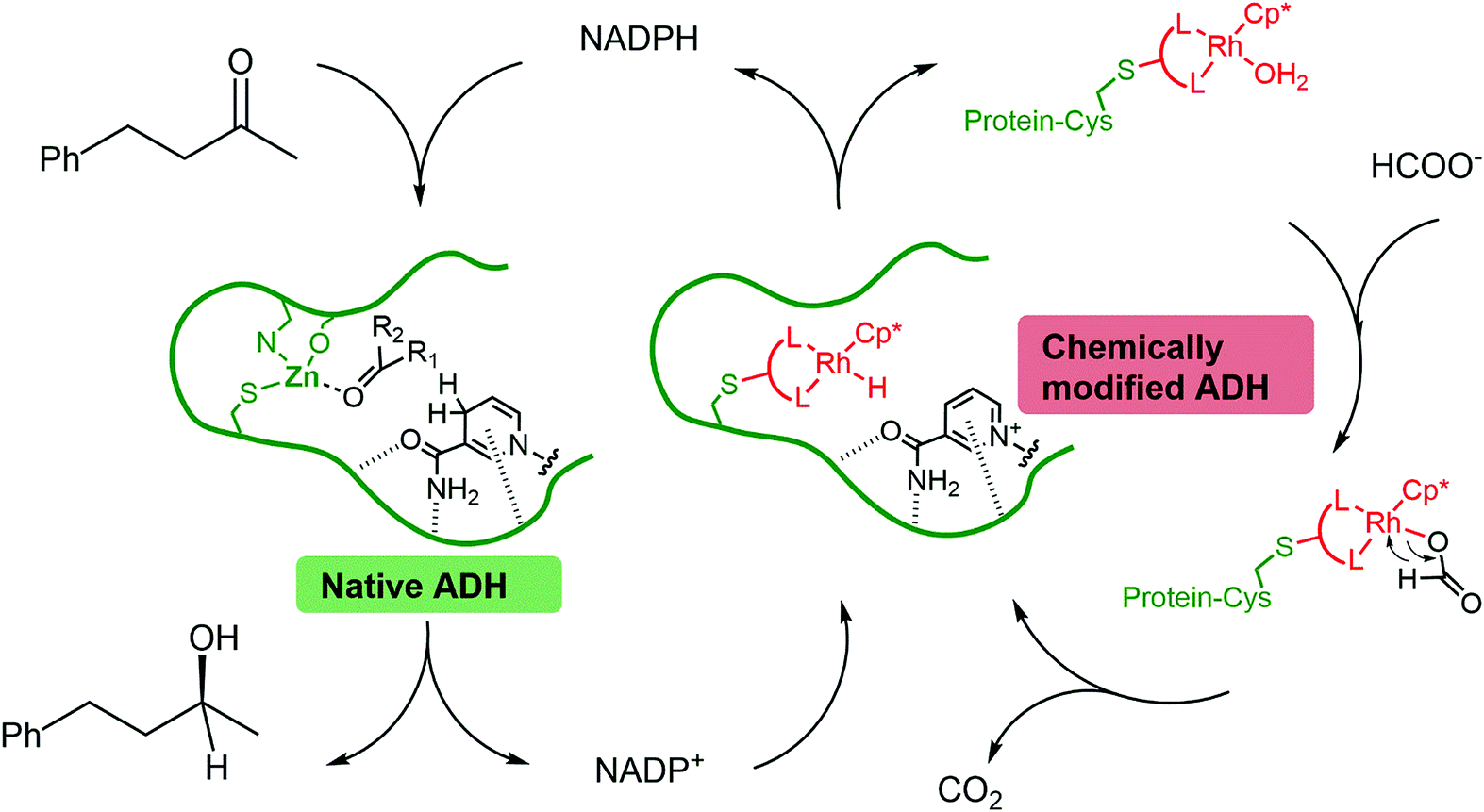
通过两个相互连接的循环合成手性醇:野生型酶(天然ADH)使用NADPH作为还原剂来还原酮。NADPH是一种以甲酸为末端还原剂,含有催化活性铑络合物(化学修饰的ADH)的突变酶再生的产物。
两个相互连接的催化循环负责手性醇的合成。首先,野生型酶对4-苯基-2-丁醇的还原作用。一种依赖于生物还原剂烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的过程。在第二个循环中,NADPH通过复合铑(III)复合物/突变酶回收,以甲酸为化学计量还原剂。酒精形成的速度很慢(转换频率为0.02秒)。- 1)过渡金属催化过程被认为是速率限制(与4.8 s的转换频率相比- 1对于酶系统)。然而,获得接近完美的对映选择性(>99%EE)
这项研究表明,过渡金属催化剂可以扩大共因子依赖酶的范围。此外,设计制备金属配合物/酶生物偶联物的策略可能对小分子合成有价值,因为酶提供了第二个配位球;封闭的空间环境是提高催化反应选择性的重要途径。
要了解更多信息,请阅读:
西蒙猜拳,安卡波尔德亚
化学。脊髓损伤,2018,9,744-754
多伊:10.1039/C8SC02371A

关于作者
Zo_Hearne是蒙特利尔麦吉尔大学化学博士生,新利手机客户端加拿大由李昭君教授指导。她来自堪培拉,澳大利亚在那里她完成了她的本科学位。她目前的研究集中在过渡金属催化作用,在实验室之外,她是一位热情的化学导师和科学传播者。新利手机客户端新利手机客户端











 关于作者
关于作者